Análisis 54: Disociación química, formación NOx (11 reacciones): Modelo de equilibrio químico.
Obtener las fracciones másicas de los productos de combustión del conjunto de reacciones de disociación siguiente:
Reacción 1: 0.5 N2 + 0.5 O2 <--> NO
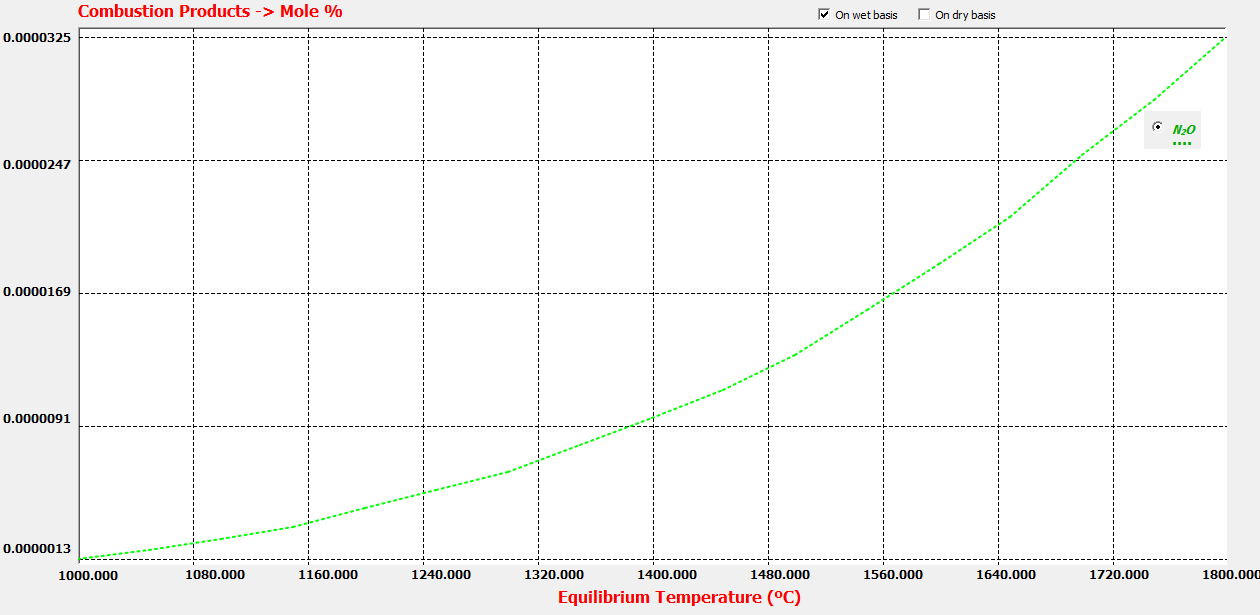
Reacción 2: NO + 0.5 N2 <--> N2O
Reacción 3: 0.5 N2 + O2 <--> NO2
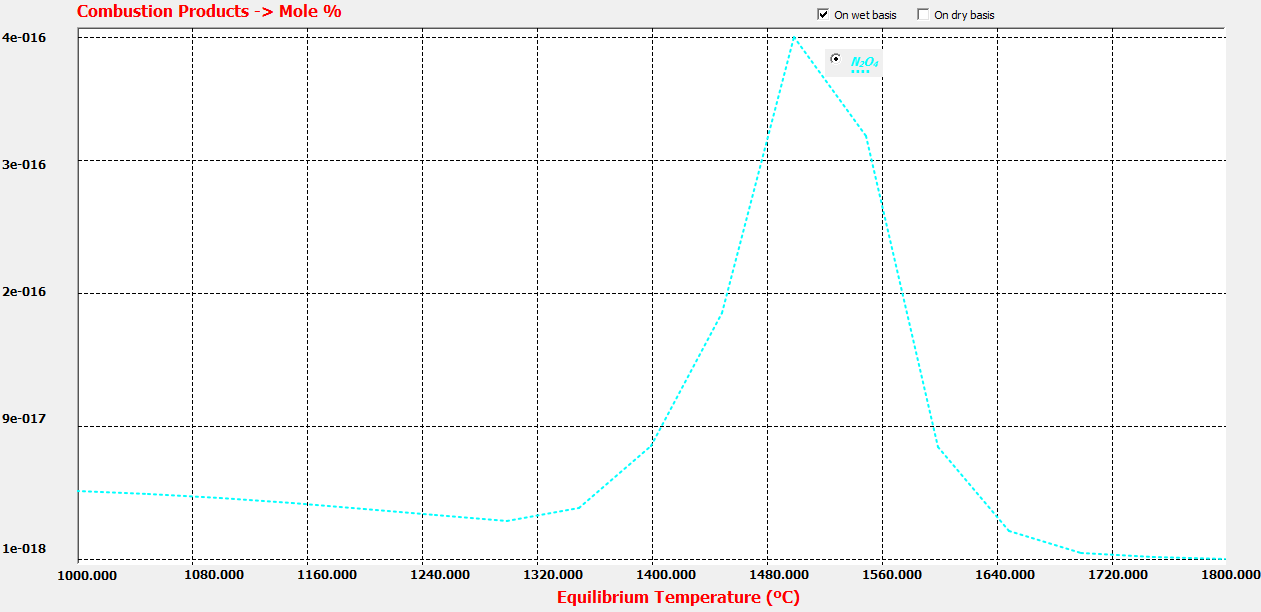
Reacción 4: 2 NO2 <--> N2O4
Reacción 5: CO2 <--> CO + 0.5 O2
Reacción 6: H2O <--> H2 + 0.5 O2
Reacción 7: H2O <--> 0.5 H2 + OH
Reacción 8: SO2 + 0.5 O2 <--> SO3
Reacción 9: 0.5 O2 <--> O
Reacción 10: 0.5 H2 <--> H
Reacción 11: 0.5 N2 <--> N
Para la combustión de una mezcla volumétrica del 70 % de CH4(g) y 30% de H2S(g) con un 200 % de aire estequiométrico, saliendo los productos de combustión a la temperatura de 1700 ºC.
Este caso ha sido resuelto previamente mediante el software EES:
K1=0.01843708
K2=4.84709
K3=0.0000888
K4=0.000000000932243
K5=0.00101717
K6=0.00023014
K7=0.00012431
K8=0.00810362
K9=0.00052803
K10=0.00132332
K11=0.000000000585138
P=100 "kPa"
Po=100 "kPa"
"Methane"
FM1=0.7
Alfa0=1
Beta0=4
Alfa=FM1*Alfa0
Beta=FM1*Beta0+FM2*2
"H2S"
FM2=1-FM1
Gamma=FM2
O2_est=Alfa+Beta/4+Gamma
lambda=2.0
Air=O2_est*lambda
"Mass balance"
N=NCO2 + NH2O + NO2 + NN2 + NNO + NN2O+ NNO2 + NN2O4 + NOH + NH2 + NSO2+ NSO3 + NO + NH+ NN
"Mass balance C"
NCO2+NCO=Alfa
"Mass balance H2O"
2*NH2O+2*NH2+NH=Beta
"2*NH2O+2*NH2=Beta"
"Mass balance N2"
2*NN2+NNO + 2*NN2O +NNO2 + 2*NN2O4 +NN=3.76*Air*2
"Mass balance O2"
2*Air=2*NCO2+NCO+NH2O+NN2O + NNO + 2*NO2 +4*NN2O4 + 2*NNO2 + NOH + 2*NSO2+ 3*NSO3 +NO
"Mass balance S"
Gamma= NSO2+ NSO3
YNO=NNO/N
PNO=YNO*P/Po
YO2=NO2/N
PO2=YO2*P/Po
YN2O=NN2O/N
PN2O=YN2O*P/Po
YN2=NN2/N
PN2=YN2*P/Po
K1=PNO/(PO2^0.5*PN2^0.5)
K2=PN2O/(PN2^0.5*PNO)
YNO2=NNO2/N
PNO2=YNO2*P/Po
K3=PNO2/(PO2*PN2^0.5)
YN2O4=NN2O4/N
PN2O4=YN2O4*P/Po
K4=PN2O4/(PNO2^2)
YCO=NCO/N
PCO=YCO*P/Po
YCO2=NCO2/N
PCO2=YCO2*P/Po
K5=PCO*PO2^0.5/PCO2
YH2O=NH2O/N
PH2O=YH2O*P/Po
YH2=NH2/N
PH2=YH2*P/Po
K6=PH2*PO2^0.5/PH2O
YOH=NOH/N
POH=YOH*P/Po
K7=POH*PH2^0.5/PH2O
YSO2=NSO2/N
PSO2=YSO2*P/Po
YSO3=NSO3/N
PSO3=YSO3*P/Po
K8=PSO3/(PSO2*PO2^0.5)
YO=NO/N
POo=YO*P/Po
K9=(POo)/PO2^0.5
YH=NH/N
PH=YH*P/Po
K10=PH/PH2^0.5
YN=NN/N
PN=YN*P/Po
K11=PN/PN2^0.5






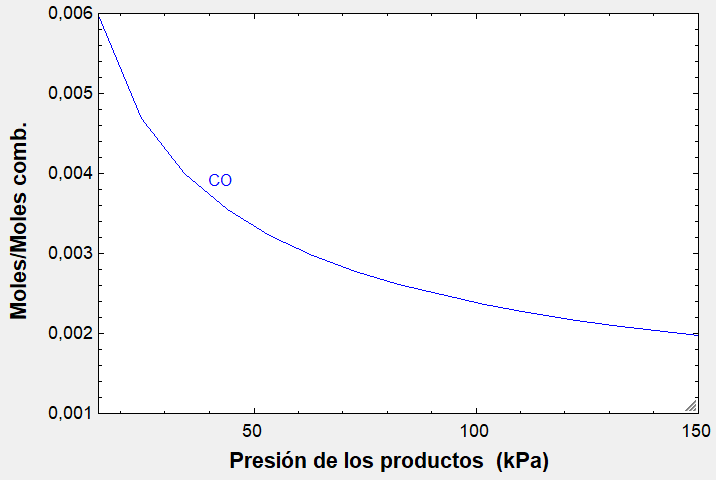

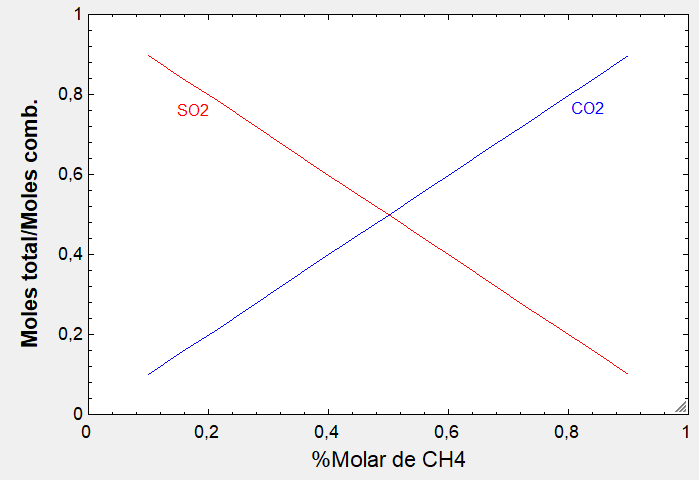

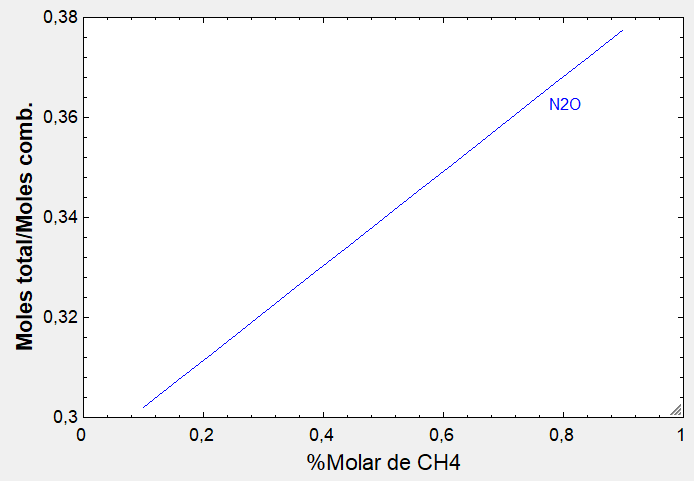

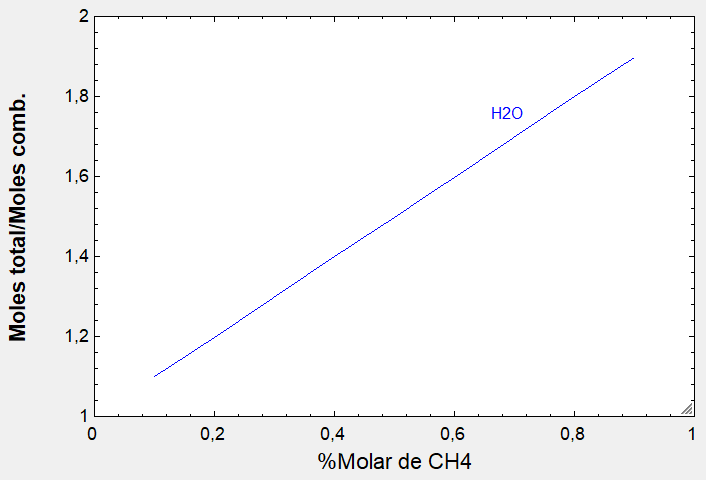

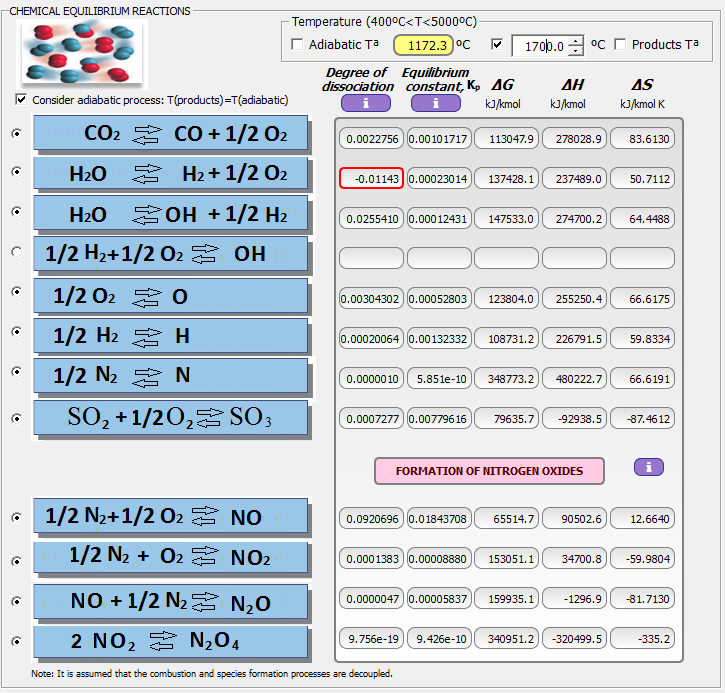
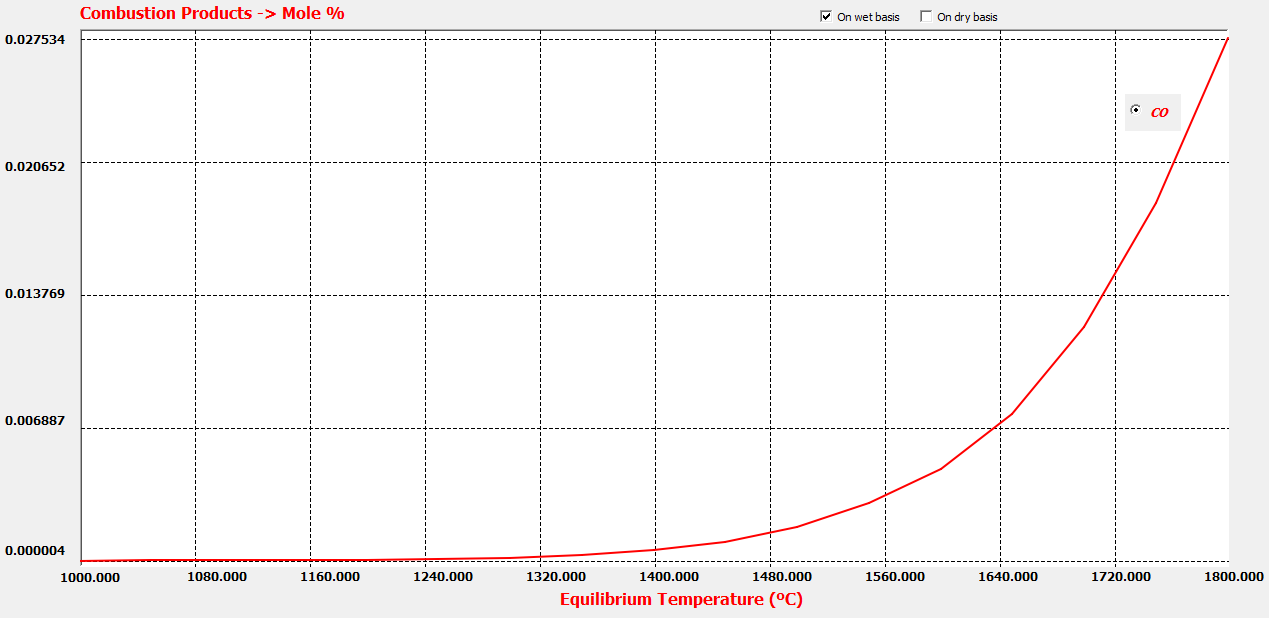
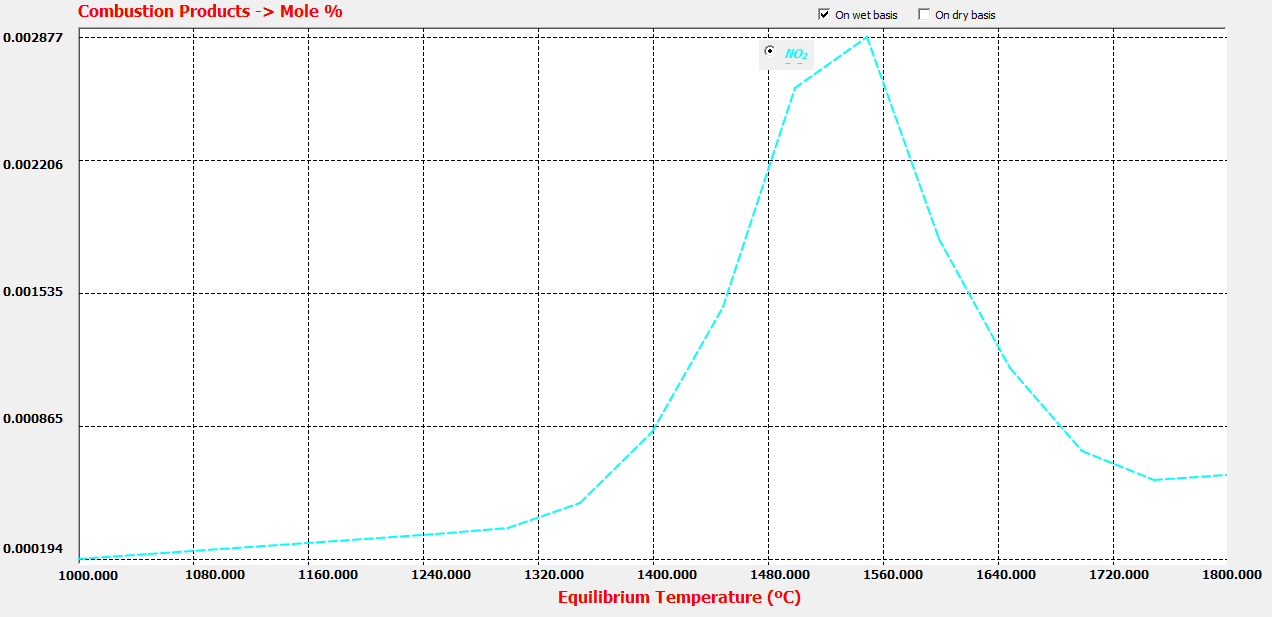
Este caso con THERMOCombustion:






Última actualización